Sekvenovanie novej generácie - manuály
Detekcia mutácií súvisiacich so vznikom cystickej fibrózy u človeka pomocou technológie sekvenovania novej generácie
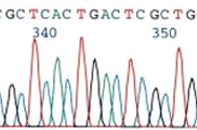
Anotácia: Cystická fibróza je monogénové ochorenie s autozómovo recesívnym typom dedičnosti, zapríčinené mutáciami v géne CFTR (Cystic Fibrosis Transmembrane Conductance Regulator). V kaukazskej populácii sa s týmto ochorením rodí jedno dieťa z 2000-3000. Doposiaľ bolo v géne CFTR identifikovaných viac ako 1900 mutácií, avšak len relatívne malý súbor mutácií je príčinou ochorenia. V súčasnosti je k dispozícii viacero metód pre identifikáciu zodpovedných mutácií, počet analyzovaných mutácií je tiež rôzny. Napríklad American College of Medical Genetics (ACMG) odporúča testovať 23 najdôležitejších mutácií. V našom experimente na detekciu mutácií využijeme metódu sekvenovania novej generácie, technológiu firmy Illumina (http://www.illumina.com) a súpravu chemikálií pre detekciu CFTR mutácií, ktorá umožňuje identifikáciu 139 mutácií v géne CFTR. Miesta jednotlivých mutácií sú ohraničené oligonukleotidovými sondami, pričom sekvencia medzi nimi sa komplementárne dosyntetizuje a spojí tak obidve sondy do jednej sekvencie. Takto vznikne súbor fragmentov DNA, ktoré sa následne amplifikujú a sekvenujú (pozri obrázok). Mutantné varianty sa porovnávajú s kontrolnou sekvenciou.
Chemikálie a materiál: komerčná súprava pre detekciu mutácií v CFTR géne kompatibilná pre aplikáciu na genetickom analyzátore (http://www.illumina.com), obsahujúca sekvenačný oligo mix, hybridizačný roztok, extenzno-ligačný mix, mix primerov C,D,E, mix primerov 1,2,10, DNA-polymerázu, PCR reakčný roztok, normalizačný roztok, PhiX internú kontrolu, sekvenačná kazeta, premývacie roztoky, PCR čistiaci roztok s magnetickými časticami, roztok pre knižnice s magnetickými časticami, premývací roztok pre knižnice, skladovací roztok pre knižnice, zrieďovací roztok pre knižnice, prietoková komôrka "Flow Cell", premývací tlmivý roztok PR2, platničky - hybridizačnú, filtračnú, amplifikačnú, čistiacu, normalizačnú, združenú platničku, elučný roztok; 10 N NaOH, TE roztok (Tris, EDTA), RNase/DNase-free voda, etanol.
Pomôcky a vybavenie: genetický analyzátor pre sekvenovanie novej generácie, platforma Illumina, termoblok, inkubátor, centrifúga, termocykler, trepačka pre platničky, magnetický stojan pre platničky, pipety, 96-jamkové platničky (0,2 μl) s krycou fóliou, nádoby na premývanie, špičky, kónické skúmavky 15 ml, mikroskúmavky 1,5 ml.
Postup:
1. Na analýzu potrebujeme vzorky genómovej DNA, vyizolovanej z krvi.
2. Na ovládacom paneli genetického analyzátora vytvoríme pracovný list
vzoriek (sample sheet), kde zadáme základné parametre o vzorkách
(pacientoch, sample ID), barcode ID z komerčnej súpravy (sekvenačnej
kazety),
použitie typov primerov. Grafický výstup vytlačíme - bude slúžiť ako
vzor pri pipetovaní vzoriek do platničky.
3. Uskutočníme hybridizáciu oligonukleotidov. Podľa grafického výstupu
z bodu 2 označíme príslušné jamky na hybridizačnej platničke a do
jamiek pridáme 5 μl každej vzorky a kontroly (50 ng/μl), ďalej pridáme
5 μl sekvenačného oligo mixu, 40 μl hybridizačného roztoku. Jemne
premiešame, platničku prikryjeme krycou fóliou, centrifugujeme 1 min.
pri 1000 x g a inkubujeme 1 min. pri 95 °C. Následne znížime teplotu
termobloku na 40 °C a necháme vzorky inkubovať, kým teplota na 40 °C
neklesne (asi 80 min.).
4. Podľa grafického výstupu
z bodu 2 označíme príslušné jamky na filtračnej
platničke, jamky premyjeme premývacím roztokom
(45 μl) a prikryté vrchnákom centrifugujeme 5 min. pri 2400 x
g. Hybridizačnú platničku so vzorkami (bod 3) centrifugujeme 1 min. pri
1000 x g a obsah jamiek z nej prenesieme do príslušných jamiek na
premytej filtračnej platničke. Premyjeme 45 μl premývacieho
roztoku a centrifugujeme 5 min. pri 2400 x g. Premývanie zopakujeme.
5. K vzorkám, zachyteným na filtračnej platničke pridáme 45 μl
extenzno-ligačného mixu. Platničku prikryjeme a inkubujeme 45 min. pri
37 °C. Týmto krokom sa sekvencia medzi sondami komplementárne
dosyntetizuje a spojí tak obidve sondy do
jednej sekvencie. Platničku centrifugujeme 2 min. pri 2400 x g
a do
každej jamky pridáme 25 μl čerstvo pripraveného 0,05 N NaOH.
Platničku prikryjeme a inkubujeme 5 min. pri izbovej teplote.
6. V mikroskúmavke zmiešame 5,6 μl DNA-polymerázy s 280 μl PCR
reakčného roztoku a premiešame. Podľa grafického výstupu
z bodu 2 označíme príslušné jamky na amplifikačnej platničke. Do jamiek
pridáme 4 μl mixu primerov C,D alebo E, 4 μl mixu
primerov 1,2 alebo 10 (kombinujeme podľa manuálu) a 22 μl
zmesi DNA-polymerázy a PCR reakčného roztoku. Následne
starostlivo do každej jamky prepipetujeme 20 μl roztoku so
vzorkami z filtračnej platničky z bodu 5. Amplifikačnú platničku
zakryjeme fóliou, centrifugujeme 1 min. pri
1000 x g a vložíme do termocyklera s nasledovným teplotným profilom:
• 3 min. pri 95°C
• 25 x 30 s. pri 95°C, 30 s. pri 62°C, 60 s. pri 72°C)
• 5 min. pri 72°C
V tomto kroku sa fragmenty DNA obsahujúce miesta mutácií amplifikujú,
pričom sa na ich konce dosyntetizujú sekvencie, umožňujúce rozpoznanie
konkrétnej mutácie (tzv. indexy) a tiež adaptéry, umožňujúce tvorbu
klastrov v rámci NGS sekvenovania "mostíkovou" PCR.
7. Podľa grafického výstupu
z bodu 2 označíme príslušné jamky na čistiacej
platničke a do každej jamky napipetujeme 45 μl PCR
čistiaceho roztoku s magnetickými časticami. Amplifikačnú platničku
centrifugujeme 1 min. pri
1000 x g a starostlivo do každej jamky prepipetujeme celý
objem roztoku so
vzorkami z amplifikačnej do čistiacej platničky. Premiešame a
inkubujeme 10 min. pri izbovej teplote. Platničku umiestnime na
magnetický stojan a po 2 min. opatrne z každej jamky odpipetujeme
všetok
supernatant. Jamky následne 2x premyjeme 200 μl 80 % etanolu.
Týmto krokom prečistíme PCR produkty od ostatných komponentov reakcie.
Platničku vyberieme z magnetického stojana a necháme vysušiť 10 min. Do
každej jamky následne napipetujeme 30 μl elučného
roztoku. Premiešame a inkubujeme 2 min. pri izbovej teplote.
8.
V mikroskúmavke zmiešame 72 μl roztoku pre knižnice s
magnetickými časticami s 394 μl normalizačného roztoku a
premiešame. Podľa grafického výstupu
z bodu 2 označíme príslušné jamky na normalizačnej
platničke. Čistiacu platničku umiestnime na
magnetický stojan a po 2 min. opatrne z každej jamky odpipetujeme
20 μl
supernatantu do príslušnej jamky na normalizačnej platničke. Do každej
jamky tiež pridáme 45 μl zmesi roztoku pre knižnice s
magnetickými
časticami a normalizačného roztoku. Platničku premiešavame na trepačke
30 min. Následne normalizačnú platničku umiestnime na
magnetický stojan a po 2 min. z každej jamky odstránime všetok
supernatant. Normalizačnú platničku vyberieme z magnetického stojana a
jamky premyjeme premývacím roztokom pre knižnice nasledovne: do každej
jamky dáme 45 μl prmývacieho roztoku, platničku premiešavame
na
trepačke 5 min., platničku umiestnime na
magnetický stojan a po 2 min. z každej jamky odstránime všetok
supernatant. Premývanie zopakujeme. Po dôkladnom odstránení zvyškov
premývacieho roztoku do každej jamky pridáme 30 μl 0,1 N NaOH a
platničku premiešavame na trepačke 5 min. V tomto kroku sa uskutočňuje
tzv. normalizácia knižníc, aby každá z knižníc mala rovnaké zastúpenie
vo výslednej združenej vzorke, ktorá sa bude sekvenovať.
9. Podľa grafického výstupu
z bodu 2 označíme príslušné jamky na združenej
platničke. Do každej
jamky pridáme 30 μl skladovacieho roztoku pre
knižnice.
Po premiešaní normalizačnú platničku umiestnime na
magnetický stojan a po 2 min. z každej jamky odpipetujeme všetok
supernatant do príslušnej jamky na združenej platničke. Platničku
prikryjeme fóliou a
centrifugujeme 1 min. pri
1000 x g.
10. Pripravíme knižnicu PhiX internej kontroly. Najskôr zmiešame
2 μl knižnice 10nM PhiX internej kontroly s 8 μl TE roztoku
(1x) a výsledný roztok zmiešame s 10 μl 0,1 N NaOH. Krátko
premiešame, centrifugujeme 1 min. pri 280 x g a
inkubujeme 4,5 min. pri izbovej teplote. 2 μl takto
pripraveného roztoku napokon zmiešame s 98 μl zrieďovacieho
roztoku pre knižnice, čím získame 20 pM roztok. Ďalej
pripravíme sekvenačnú kazetu tak, že ju rozmrazíme v
deionizovanej vode ponorením po
vyznačenú rysku. Asi po 1 hod. kazetu osušíme a vizuálne
skontrolujeme tekutý stav reagentov v jednotlivých pozíciách.
11. Do 1,5 ml mikroskúmavky (ZK) prenesieme po 5 μl roztoku z každej
knižnice zo združenej platničky a premiešame. Do inej 1,5 ml
mikroskúmavky (PX) dáme 585 μl zrieďovacieho roztoku pre
knižnice a pridáme 6 μl PhiX internej kontroly (20 pM),
premiešame. Následne prenesieme 9 μl zmesi knižníc zo skúmavky ZK do
skúmavky PX, premiešame, centrifugujeme 1 min. pri
1000 x g a inkubujeme 2 min. pri 96 °C. Skúmavku následne ponoríme do
kúpeľa s ľadovou vodou a inkubujeme 5 min.
12. Výslednú zmes z mikroskúmavky z predchádzajúceho bodu napipetujeme
do príslušnej pozície (Load Samples) v pripravenej sekvenačnej kazete.
V softwarovom rozhraní genetického analyzátora nastavíme sekvenačný beh
(Sequence). Premyjeme a dôkladne osušíme prietokovú komôrku a
vložíme ju do prístroja. Do prístroja na príslušné miesto tiež vložíme
nádobu s premývacím tlmivým roztokom PR2 a odpadovú nádobu. Následne do
prístroja vložíme sekvenačnú kazetu. Skontrolujeme parametre a
výsledky kontroly pred vlastným behom.
13. Spustíme sekvenačný beh (Start Run). Priebeh behu môžeme sledovať cez
rozhranie MCS alebo pomocou ďalšieho počítača cez Sequencing Analysis
Viewer (SAV). Sekvenačné dáta môžeme analyzovať na počítači pomocou
funkcie Reporter alebo na „cloud-e“ pomocou tzv. BaseSpace. Obidva
systémy poskytujú informácie o priradení, variantoch a priradení
contigov ku každému genómu a pre každú vzorku.